等比定律
我们都知道物质是由原子组成的。令人惊讶的是,希腊哲学家在公元前五世纪(BCE)提出了原子的概念。然而,他们的概念是哲学的而不是科学的。
约翰道尔顿提出了第一个关于原子的科学理论。 JJ Thomson、卢瑟福、尼尔的玻尔和薛定谔的研究后来证明道尔顿的原子假设很少是错误的。研究的结果是克服了道尔顿理论的大部分限制,提出了一种新的假设,即现代原子论。以下是当前原子理论的主要假设:
- 一个原子不能再分成两部分。
- 相同元素的原子可以具有不同的原子质量。
- 多个元素的原子质量可以相同。
- 可以将一种元素的原子转化为其他元素的原子。换句话说,原子不再是牢不可破的。
- 原子并不总是以直接的整数比组合。
- 参与化学反应的最小粒子是原子。
- 原子的质量可以转化为能量。
什么是原子?
原子是元素的最小粒子,它可能有也可能没有独立存在,但总是存在于化学反应中。原子是元素中保留其特性的最小单位。原子是由原子组成的,原子不能被创造或毁灭。不同的元素具有不同种类的原子,但同一元素的所有原子都是相同的。当原子重新排列时,就会发生化学反应。
原子质量和原子质量单位:一个原子(或一组原子)的平均质量等于电子、中子和质子的质量之和。原子质量是指单个原子的质量。这通常以国际协议(AMU)规定的统一原子质量单位来表述。质量是基态碳 12 原子的 1/12。
什么是分子?
分子由一个或多个通过化学键结合在一起的原子组成。分子是物质的最小单位,仍然可以归类为同一物质。它由化学连接在一起的两个或多个原子组成。
例如水(H2O),
Examples:
- H2O water
- N2 nitrogen
- O3 ozone
- CaO calcium oxide
- C6H12O6 glucose
- NaCl table salt
什么是分子量?
元素的原子质量乘以分子中的原子数,然后将分子中所有元素的质量相加。
化学结合定律
化学是研究物质从一种状态到另一种状态的变化。两种不同形式的物质混合经常会导致这些变化。某些基本规律调节不同成分的混合以产生化合物。化学结合定律是这些规则的名称。
质量守恒定律
该定律断言,物质和能量都不能产生或破坏。换句话说,总质量,即反应混合物的质量和生成的产物质量的总和,保持不变。 1789 年,安托万·拉瓦锡根据他在观察各种燃烧过程后收集的数据发表了这条定律。
定比例定律
根据恒定成分定律,化合物是由元素组成的,这些元素基于它们的质量以给定的比例存在。这意味着化合物的任何纯样品,无论其来源如何,都将始终以相同的质量比例包含相同类型的组分。考虑纯水的情况,它总是含有一定质量比的氢和氧原子。以 1:8 的比例,一克水含有大约 0.11 克氢气和 0.88 克氧气。
普鲁斯特定律是定比例定律的另一个名称。在某些化合物中,它是指元素的质量比。考虑 NO2 分子中氮原子和氧原子的数量为 1:2,但它们的质量比为 7:16。
1794 年,法国科学家约瑟夫·普鲁斯特(Joseph Proust)从他对硫酸盐、金属氧化物和硫化物的研究中发展了这个恒定比例定律。自从道尔顿的原子理论引入以来,这个定律也受到了人们的青睐。 1811 年,瑞典科学家 Jacob Berzelius 确定了它们之间的联系。
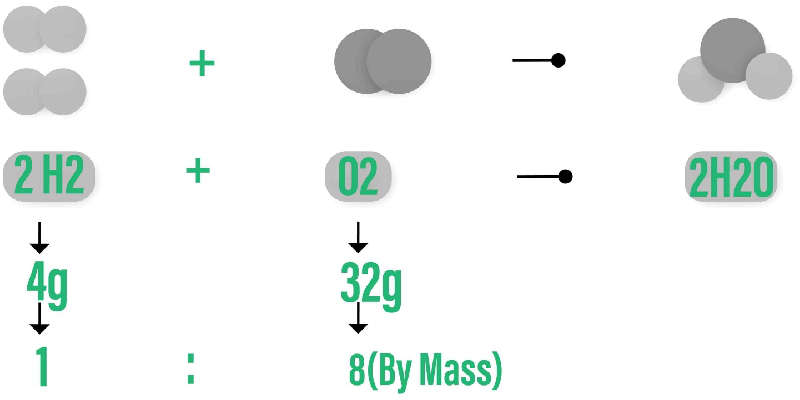
等比例定律的图示
非化学计量化合物
尽管定比例定律在现代化学的发展中很重要,但它并不是普遍适用的。出现非化学计量物质,这意味着它们的元素组成因样品而异。倍数比例定律适用于此类化合物。例如,对于每个氧原子,氧化铁方晶石可以具有 0.83 到 0.95 个铁原子,从而产生 23% 到 25% 的氧质量。由于晶体空位,最佳配方是FeO,但更接近Fe0.95O。普鲁斯特的测量不够精确,无法发现这些差异。此外,元素的同位素组成因来源而异,因此即使是纯化学计量化合物的质量贡献也会波动。因为天文、大气、海洋、地壳和地球深处的过程可能优先集中特定的环境同位素,所以这种变化被用于辐射测年。除氢及其同位素外,影响通常很小,但可以用当前仪器测量。即使是“纯”的,许多天然聚合物(如 DNA、蛋白质和碳水化合物)也具有不同的成分。除非它们的分子量一致(单分散)且化学计量不变,否则聚合物不被视为“纯化合物”。由于同位素差异,在这种特殊情况下,他们可能仍然违反法律。
等比例定律的例外情况
恒比例定律是化学发展的基石,但它并不适用于所有化学物质,也有一些例外。下面列出了该规则的一些例外情况。
- 几种非化学计量化合物中的成分比例往往在样品之间有所不同。因此,他们倾向于遵循多重比例定律。
- 具有分子式 FeO 的氧化铁方晶石就是一个例子。铁与氧原子的比例在 0.83:1 和 0.95:1 之间变化。这是由于原子的无序组织导致样品中存在晶体空隙。
- 组成元素的同位素组成因物质样品而异。这往往会导致质量比发生变化。
- 由于在几个地壳和地球深处过程中同位素的优先浓度,样品之间这些质量比的差异有助于地球化学测年。
- 这也发生在各种大气、天文和海洋现象中。即使影响很小,当代技术也解决了衡量它们的障碍。
- 由于这些天然聚合物的组成各不相同,因此几个样品具有不同的质量比例。
等比例定律的例子
- 氢和氧原子都可以在水中找到。水分子由一个氧原子和两个氢原子组成。
- Na和Cl原子组成盐或NaCl。钠和氯原子的比例必须完全相同才能形成。
- 氢、氧和硫原子组成硫酸。对于要形成的酸,所有三个原子的比例必须相同。
示例问题
问题1 不等比定律的例外是什么?
回答
In non-stoichiometric compounds, the element ratio fluctuates from sample to sample. As a result, the law of constant proportions does not apply to these compounds. Because the masses of two different isotopes of an element differ, samples of elements with varying isotopic compositions can likewise defy the law of definite proportions. Natural polymers have also been shown to defy the proportional law.
Ques-2 分析表明,0.24 克氧和硼化合物样品含有 0.096 克硼和 0.144 克氧。根据其质量计算化合物的 % 组成。
回答
(i) Mass of boron in compound = 0.096 g
And, Mass of compound = 0.24g
So, Percentage of boron
(in compound) = Mass of boron in compound Mass of Compound X =100
=0.0960.24×100
= 40
(ii) Mass of oxygen in compound = 0.144 g
And, Mass of compound = 0.24g
So, Percentage of oxygen = Mass of Oxygen in compound Mass of compound X= 100
=0.1440.24×100
= 60
Thus, the percentage composition of the compound is : Boron = 40 %; Oxygen = 60 %.
问题 3 谁是第一个提出定比例定律的人?
回答
In the year 1779, the French scientist Joseph Louis Proust proposed the law of definite proportions for the first time. This is why the law is also referred to as Proust’s law. The French chemists Antoine Lavoisier and Joseph Priestley were the first to make the discoveries that led to this law.
问题 4 列出一些遵循一定比例定律的化合物。
回答
The hydrogen and oxygen atoms in water molecules are arranged in a 2:1 ratio. Water molecules follow the law of constant proportions because they have a set mass ratio. Methane is another chemical molecule that follows the law of constant proportions. Four hydrogen atoms join with one carbon atom to produce a methane molecule.
问题 5 解释并陈述定比例定律。
回答
Proust’s law, or the law of definite proportion, is another name for the law of constant proportion. This law asserts that any chemical compound has a fixed mass ratio of its constituent parts. It is unaffected by the technique of preparation or the source. As a result, if 1/4 of one chemical is coupled with 3/4 of another chemical to make a compound, these proportions will always be true regardless of the amount of chemicals added.
This law of constant proportion ensures that chemical compounds are formed in such a way that their proportions remain consistent no matter how much of the compound is prepared.
Ques-6 一个化学过程在加热时从 150 克小苏打混合物中产生 87 克二氧化碳气体,该混合物由碳酸氢钠和醋混合而成。食物中会残留多少固体残渣?
回答
Total mass of reactants = Total mass of products, according to the law of conservation of mass.
On heating, the baking soda combination (reactant) produces solid residue and carbon dioxide ( products).
On heating, the baking soda combination (reactant) produces solid residue and carbon dioxide ( products).
Mass of baking soda=Mass of solid residue + Mass of carbon dioxide
Hence, the mass of solid residue is 150g – 87g = 63g.
Ques-7 说到原子和分子,有什么区别?
回答
An atom is a microscopic particle of a chemical element that may or may not exist independently. Molecules are the smallest unit in a complex, consisting of a group of atoms that the bond links together. Chemical bonds exist between two or more identical or different atoms.