价和价电子:定义、例子和关系
元素原子具有与其他元素原子结合的天然能力。当两个或多个相同或不同元素的原子结合形成稳定的结构时,就会形成分子。一个钠原子和一个氯分子结合形成一个氯化钠分子,而一个氢原子和一个氟分子结合形成一个氟化氢分子。每个原子都有一些与其他原子混合的能力。化合价是指元素结合其组成原子的能力。氢和氯被认为具有相同的化合价。其他元素的化合价是通过将它们与氢或氯进行比较来确定的。
Atoms are made up of electrons, protons and neutrons. Generally, protons and neutrons lie at the center of an atom called the nucleus and electrons revolve around the nucleus in a fixed path called orbits or shells.
外壳命名为“K”、“L”、“M”、“N”等。最内层是“K”壳,最多包含 2 个电子,其次是“L”壳,最多包含 8 个电子,然后是“M”壳,最多包含 18 个电子,然后是“N”壳包含多达 32 个电子。不同类型的原子聚集在一起形成元素。
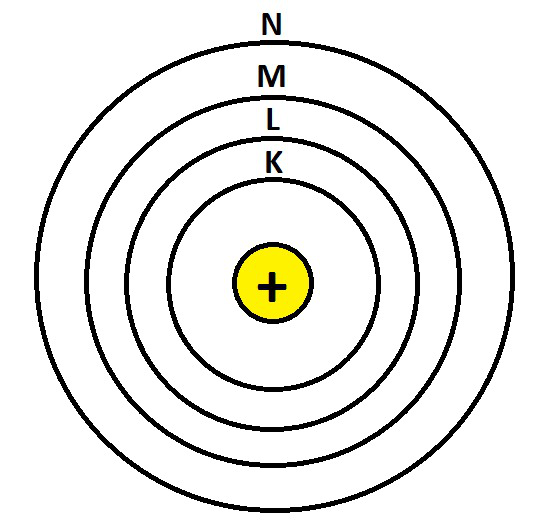
原子结构
什么是价电子?
原子核周围最外层的电子称为价电子。价电子很重要,因为它们提供了有关元素化学特性的详细信息,例如它本质上是负电还是正电,或者化合物的键序,这表明两个原子之间可能形成的键数。
因此,价电子定义为,
The number of electrons present in the outermost shell of an element that takes part in chemical bonding is called valence electrons.
例如,锂 (Li) 的原子序数等于 3。其电子配置为 K = 2 和 L = 1,这意味着 K 亚壳层完全充满而 L 亚壳层即最外层只有 1 个电子,这是它的化合价电子如下图所示:
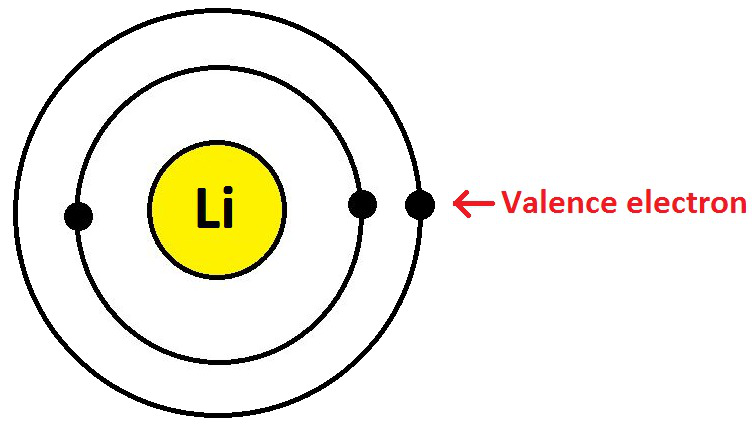
锂原子中的价电子
原子结构的变化仅限于最外层的电子,即价电子,无论原子之间的化学相互作用类型如何,无论是离子键、共价键还是金属键。
价电子是附着在原子上的电子,可用于建立化学相互作用;在单个共价键中,两个原子贡献一个价电子以形成共享对。价电子的数量会影响元素的化学特性以及它与其他元素相互作用的能力:
- 主族元素中的价电子只能在最外层的电子壳层中。
- 在化学上,具有闭合价电子壳的原子是惰性的。因为额外的价电子被迅速去除以产生正离子,所以一个比封闭壳多一个或两个价电子的原子具有极强的反应性。
- 由于倾向于获得丢失的价电子(产生负离子)或共享价电子,因此具有比闭合壳少一个或两个价电子的原子也具有极强的反应性(从而形成共价键)。
- 价电子,就像内壳中的电子一样,可以以光子的形式接收或释放能量。当电子获得足够的能量迁移(跳跃)到外壳时,就会发生原子激发。
- 当电子脱离其相关原子的价壳层时,就会发生电离,从而形成正离子。当电子失去能量(并因此发射光子)时,它可能会迁移到未完全占据的内壳。
原子中价电子的测定
尽管随着我们向下移动,壳层的数量会增加,但价电子的数量保持不变。
虽然价电子的数量会随着时间增加 1,但壳层的数量保持不变。元素核周围的壳数由周期数(行号)表示。
什么是效价?
The valency of an atom is equal to the number of valence electrons that this atom can gain or lose during chemical reactions. Or in other words:
The amount of hydrogen atoms, chlorine atoms, or double the number of oxygen atoms that one atom of an element may combine with is referred to as its valency.
元素的化合价是指该元素中参与化学过程的价电子数。当两种或多种成分以一定的质量比例结合时,就会产生一种化合物。当一种元素的一个原子与另一种元素的特定数量的原子结合时,就会形成稳定的化合物。所有组件都有不同的混合能力。
金属化合价
金属是在其价壳层中具有一个、两个或三个电子的元素(氢和氦除外,它们是非金属)。在化学过程中,金属倾向于脱落它们的价电子并完成它们的八位字节。所以,
金属元素的化合价=其价壳中的电子数
元素周期表第 1、2 和 13 族的元素分别具有 1、2、3 价,这与它们最后一个壳层中的电子构型相似。
例如:
- 钠 (Na)
Na 的电子构型为 11 (K = 2; L = 8; M = 1)。它们的最外层有 1 个电子。因此,钠的化合价为 1,如下所示:
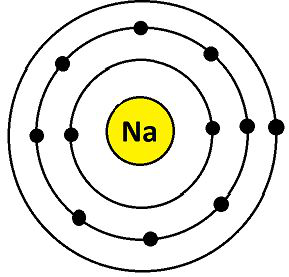
钠的化合价
- 镁 (Mg)
Mg 的电子构型为 12(K = 2;L = 8;M = 2)。它们的最外层有 2 个电子。因此,镁的化合价为 2,如下所示:
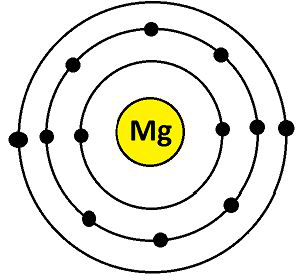
镁的化合价
- 铝 (Al)
Al 的电子配置是 13 (K = 2; L = 8; M= 3)。它们的最外层有 3 个电子。因此,铝的化合价为 3,如下所示:
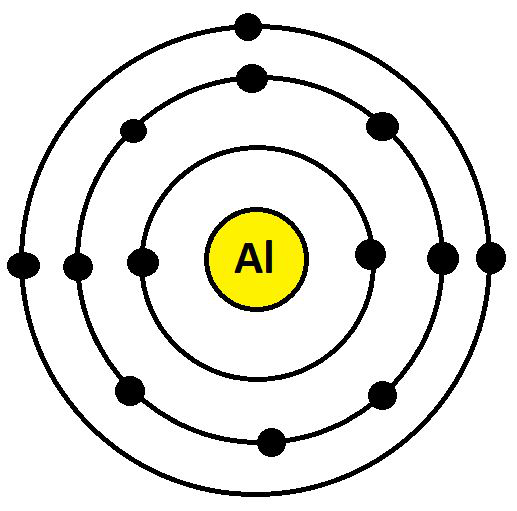
铝的化合价
非金属化合价
如果元素的价壳层有 5 个或 6 个或 7 个或 8 个电子,则它被归类为非金属。要完成其八位字节,非金属需要 3 或 2 或 1 或 0 个电子。因此,非金属元素的化合价 = 8 – 其最外层的电子数。
元素周期表第 15、16 和 17 族的元素在其最后一个壳层中分别有 5、6、7 个电子,因此非金属的化合价取决于找到完成其八位字节配置所需的电子数。
例如:
- 氮 (N)
N 的电子配置为 7 (K = 2; L = 5; M= 0)。它们的最外层有 5 个电子。因此,氮的化合价为:8 – 5 = 3,如下所示:
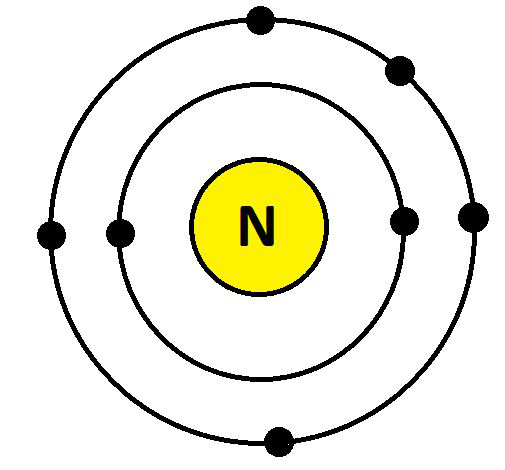
氮的化合价
- 氧气 (O)
O 的电子构型为 8 (K = 2; L = 6; M= 0),它们的最外层有 6 个电子。因此,氧的化合价为:8 – 6 = 2,如下所示:
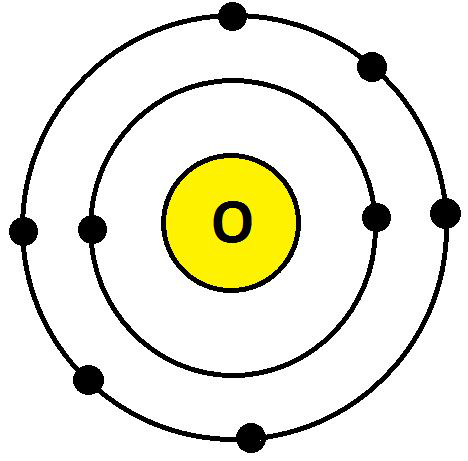
氧价
- 氟 (F)
F 的电子配置为 9 (K = 2; L = 7; M= 0)。它们的最外层有 7 个电子。因此,氟的化合价为:8 – 7 = 1,如下所示:
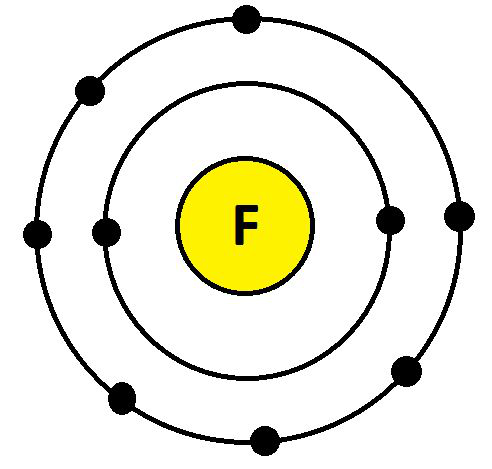
氟的化合价
诺贝尔气体的化合价
元素周期表的第 18 族元素被称为惰性气体,因为它们根本不发生反应,因为它们具有最稳定的电子配置,因为它们的外壳中具有最大数量的价电子。由于每个惰性气体的最外层都被填充,化合价为零,因此它们不会失去或获得任何电子。
例如:
- 霓虹灯(氖)
Ne 的电子构型为 10 (K = 2; L = 8; M= 0)。它们的最外层有 8 个电子。所以,氖的化合价是:8 – 8 = 0。
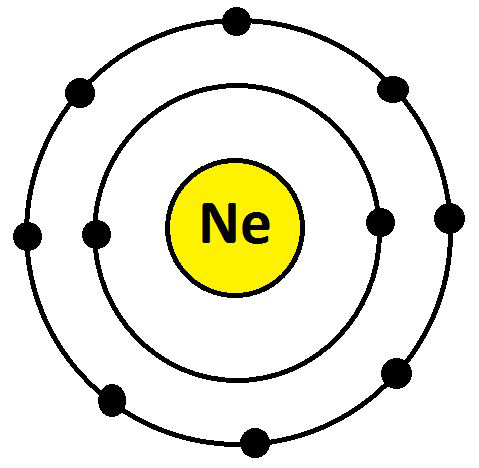
霓虹的化合价
化合价和价电子之间的关系
化合价解释了原子的键形成。而价电子与元素字符有关。化合价只是一个概念或想法,不涉及电子的传输。然而,价电子涉及电子在键形成中的传输。价电子和价电子都适用于任何化学元素。
由于只有价电子(最外层电子)参与化学键合,因此元素的化合价取决于其原子中价电子(最外层电子)的数量。元素原子中的价电子数量或在价层中完成八个电子所需的电子数量决定了元素的化合价。例如,钠含有一个价电子,因此含有一价电子。结果,钠的化合价等于其原子中价电子的数量。金属元素的化合价通常等于其原子中的价电子数。
金属的化合价=其原子中的价电子数
价电子,就像内壳中的电子一样,可以以光子的形式接收或释放能量。当电子获得足够的能量迁移(跳跃)到外壳时,就会发生原子激发。当电子脱离其相关原子的价壳层时,就会发生电离,从而形成正离子。当电子失去能量(并因此发射光子)时,它可能会迁移到未完全占据的内壳。
非金属的价数 = 8 – 其原子中的价电子数
氢的化合价是这个规则的一个例外。氢的化合价等于价电子数,为一(尽管氢是一种非金属元素)。

氢的化合价
示例问题
问题 1:命名参与键形成的原子的电子?
回答:
Only valence electrons of an atom are involved in bond formation.
问题2:氯原子的电子分布是什么?最后一层有多少电子?
回答:
Since, the atomic number of a Chlorine atom (Cl) is 17.
Therefore, the electronic distribution of Cl: K = 2, L = 8, M = 7
And the last shell has 7 electrons.
问题 3:带正电的钠离子 (Na + ) 的电子构型是什么?
回答:
We know that, Atomic number of Na is 11
Since, Atomic number = Number of protons = 11
Also, in a neutral atom the number of protons = number of electrons = 11
So, Number of electrons in (Na+) ion = 11 – 1 = 10
Thus, the electronic configuration of (Na+) ion is K = 2, L = 8.
问题 4:元素“E”在“M”壳层中包含 7 个电子作为价电子。 “E”的原子序数是多少?还要检查“E”是金属还是非金属。
回答:
As ‘E’ has 7 electrons in the ‘M’ shell as valence electrons, the electronic configuration of ‘E’ is K = 2, L = 8, M = 7.
This implies, the atomic number is 17.
Also, we know that elements of groups 15, 16, 17 along with Hydrogen is non – metal.
So, ‘E’ is a non – metal.
问题5:锂的原子序数是3。它的质量数是7。一个锂原子中有多少个质子和中子?
回答:
We know that,
Number of neutrons = Mass number – Atomic number
So, Number of neutrons = 7 – 3 = 4
And, Number of protons = Atomic number
Hence, Number of protons = 3.
问题 6:为什么氦、氖和氩的化合价为零?
回答:
The mentioned elements belong to the group 18 of the periodic table. According to that, the outermost shell of Helium, Neon and Argon is completely filled . They do not have any tendency to combine with other elements. Hence, they have zero valency.
问题 7:元素 X 的原子的最外层存在一个电子。如果从最外层移除该电子,形成的离子上的电荷性质和值是什么?
回答:
Only one electron is present in the case of metals of group 1. According to that, element ‘X’ has only one electron in it’s outermost shell i.e, valence electron. It will donate this electron inorder to form ion and achieve the octet state. The charge will be +1.