化学结合定律
化学是研究物质从一种形式转变为另一种形式的研究。这些转变通常是由两种不同类型物质的相互作用引起的。某些基本规则管理不同元素的组合以形成化合物。这些规则被称为化学结合定律。
当物质在化学反应中与另一种物质发生反应或结合时,它会改变其形式、性质和特性。在化学反应中,化学结合的规律支配着物质、能量和转化之间的关系。元素的化学结合受化学结合的五个基本定律支配:
质量守恒定律
Antoine Lavoisier 于 1789 年制定了这条定律。根据该定律,“质量不能在化学反应中产生或破坏。”
该定律指出,每当物质在封闭系统中发生化学或物理变化时,反应物质(反应物)的总质量正好等于反应产物的总质量。因为不允许产物或反应物离开系统,所以没有物质损失并且质量是守恒的。
例子:看看水分子的形成。当氢和氧结合时形成水分子。

In the above example 2 molecules of Hydrogen combines with 1 molecule of Oxygen to form 2 molecules of water.
The masses of H is 1unit and O is 16 unit.
Mass of 2 molecules of Hydrogen (2H2) : 4 unit.
Mass of 1 molecules of Oxygen (O2) : 32 unit.
Mass of 2 molecule of water (2H2O) : 36 unit.
2H2 + O2 ———> 2H2O
4 unit 32 unit 36 unit
The total mass of the reactants equals the total mass of the products in this case. Furthermore, the number of hydrogen and oxygen atoms in the reactants and products sides is equal.
定比例定律
1799 年,约瑟夫·路易斯·普鲁斯特(Joseph Louis Proust)发展并证明了这条定律。根据法律,“元素总是以一定的质量比例存在于化学物质中。”
当化合物被破坏时,根据恒比例定律,组成元素的质量保持相同的比例。或者,在化合物中,元素总是以确定的质量比例存在。简单来说,给定化合物中元素的重量百分比组成将始终保持不变,无论其来源、来源或数量如何。
示例:考虑不同的氮氧化物分子。
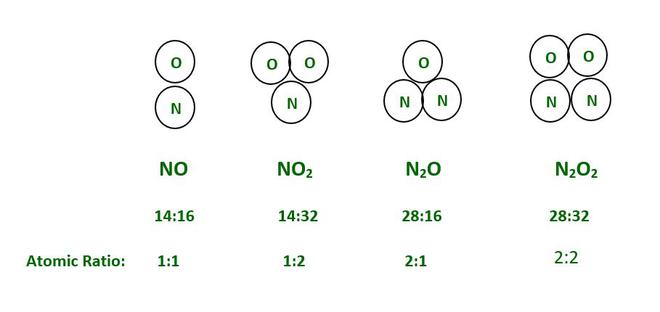
In the above example of oxides of Nitrogen if we take any amount of Oxygen and Nitrogen in sample then the ratio of formed NO will always 1:1. Similarly, the ratio for NO2, N2O and N2O2 will be 1:2, 2:1 and 2:2 respectively. This is guaranteed by the law of definite proportions.
倍数定律
道尔顿在 1803 年颁布了这条定律。这条定律规定“如果两种元素结合形成一种以上的化合物,它们在反应中的质量是小整数的比值。”
根据多重比例定律,当两种元素结合形成一种以上的化合物时,一种元素的质量与另一种元素的固定质量相结合,总是整数的比值。
例子:
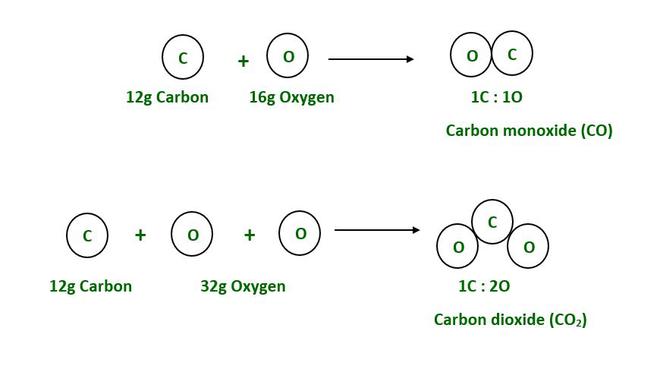
碳和氧结合形成两种不同的化合物(在不同的情况下)。第一种是最常见的气体CO 2 (二氧化碳),第二种是CO(一氧化碳)。
We know that,
The mass of Carbon is 12g.
The mass of Oxygen is 16g.
As a result, 12g of carbon combines with 32g of oxygen to form CO2.
Likewise, 12g of carbon reacts with 16g of oxygen to form CO.
As a result, the oxygen ratio in the first and second compounds is 2:1= 32/16 =2, (whole number).
Gay Lussac 气体体积定律
Gay Lussac 在 1808 年根据他的观察制定了这条定律。这条定律指出,“当气体在化学反应中产生或结合时,只要所有气体处于相同的温度和压力下,它们就会以简单的体积比进行。”
该定律被认为是一种不同类型的确定比例定律。这两种化学结合定律的区别在于,盖卢萨克定律以体积表示,而定比定律以质量表示。
例子:
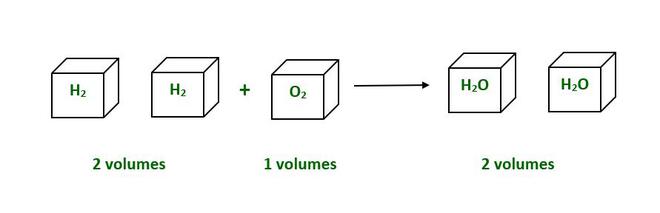
In the above example 2 volumes of H2 combines 1 volume of O2 to form 2 volumes of H2O.
H2 (g) + O2 (g) ——–> 2H2O (g)
阿伏伽德罗定律
1811 年,阿伏伽德罗提出了这条定律。根据这条定律,“在相同的温度和压力条件下,相同体积的所有气体包含相同数量的分子。”这意味着在相同的温度和压力下,两升氢气的分子数与两升氧气的分子数相同。
例子:

Equivalent volumes of different gases contain the same number of molecules at the same temperature and pressure. In the above example CL2 and H₂ has 1 volume each combines to form 2 volume of HCL.
Here,
Mole is a unit of measurement for substance. 1 mole substance contains 6.02214076×10²³ particles.