氢原子的光谱
氢原子中的电子围绕原子核旋转。由于质子和电子之间的电磁力,电子会经历许多量子态。尼尔玻尔的模型有助于将这些量子态可视化为电子以不同方向围绕原子核运行。
When Electrons in an atom are supplied energy, they get excited and jump from a lower energy level to a higher energy level. As we know electrons always try to remain in their lowest energy level, the excited electrons go back to their original level and emit radiation in this process. This phenomenon explains the emission spectrum via hydrogen, sometimes known as a hydrogen emission spectrum.
我们将进行一个实验,以更好地了解氢发射光谱是什么。考虑一个携带低压气态氢的细管。然后将电极连接到容器的两端。现在,如果我们对电极施加高电压,我们可以在管中看到粉红色的光芒(明亮)。我们知道棱镜通过衍射将穿过它的光分开。可见光谱是氢发射光谱的一个子集。因为光线是紫外线,我们的眼睛无法感知其中的大部分。电子从高能态跃迁到低能态是氢线发射光谱的主要原因。

什么是光谱发射?
当电子从较高能量状态跃迁或跳跃到较低能量状态时,会发生光谱发射。为了区分这两种状态,较低的能级用n 1表示,而较高的能级用n 2表示。两种状态之间的能量差对应于发射的光子的能量差。因为每个状态的能量是固定的,所以它们之间的能量差也是固定的,跃迁总是会产生相同能量的光子。

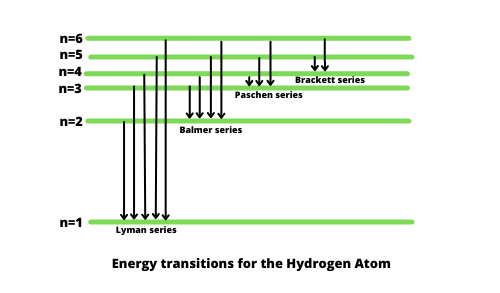
氢的电子跃迁及其产生的波长。
原子的量子化能级导致光谱具有代表这些能级差异的波长。

氢谱系列
因为氢原子是自然界已知的最简单的原子系统,所以它构成了这个系列中最简单的。当光或辐射束通过狭缝进入设备时,光或辐射的每个单独分量都会形成光源的图像。当用分光镜解析时,可以看到这些图像。获得的图像将呈平行线的形状,彼此相邻且间距均匀。当从较高波长侧向较低波长侧移动时,这些线将在较高波长侧相距较远,而在较低波长侧逐渐闭合。系列极限是具有最少分离光谱线的最短波长。
1885 年,瑞典学校教师约翰·雅各布·巴尔默(Johann Jakob Balmer,1825-1898 年)在氢光谱的可见区域观察到了第一个此类系列。 Balmer 系列是氢发射光谱的一部分,负责将电子从第二层激发到任何其他层。其他此类系列如下所述:
- 莱曼级数:电子从任何其他壳层移动到第一个壳层。
- Balmer 系列:电子从任何其他外壳移动到第二个外壳。
- Paschen 系列:电子从任何其他壳移动到第三壳。
- 括号系列:电子从任何其他壳移动到第四壳。
- Pfund 系列:电子从任何其他壳移动到第五壳。
里德堡公式
玻尔模型中能级之间的能量差异,以及发射或吸收光子的波长,由里德堡公式给出:
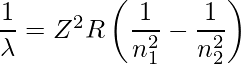
在哪里,
- Z是原子序数,
- n 1是低能级的主量子数,
- n 2是上能级的主量子数,并且
- R 是里德堡常数。 (氢气为1.09677×10 7 m -1 ,重金属为1.09737×10 7 m -1 )。
波长将始终为正,因为 n1 被定义为较低水平,因此小于 n2。该方程适用于所有类氢物质,即只有一个电子的原子,氢谱线的特殊情况由 Z=1 给出。
示例问题
问题1:在氢原子中,电子从第二态跃迁到第一激发态,然后跃迁到基态。确定这些跃迁所属的光谱系列。
解决方案:
Since the atom’s transition is to the first shell, it falls under the category of Layman’s series.
问题 2:求 Balmer 级数最后一行和 Lyman 级数最后一行的波长之比。
解决方案:
We know that,
1/λ=Z2R[1/n12−1/n22]
For the last Balmer series
n1 = 2, n2 = ∞ , Z = 1
1/λb=R[1/22−1/∞2]
λb = 4/R
Similarly, For the last Lyman series
1/λl = R[1/12−1/∞2]
λ1 = 1/R
λb/λl = (4/R)/(1/R)
λb/λl = 4
The ratio of wavelengths of the last line of the Balmer series and the last line of the Lyman series is 4.
问题 3:氢光谱中的 Balmer 级数对应于从 n1 = 2 到 n2 = 3,4 的跃迁,... 这个级数位于可见区域。计算当电子移动到 n = 4 轨道时与 Balmer 系列中的跃迁相关的线的波数。
解决方案:
We know that
1/λ = Z2R(1/n12-1/n22)
Given,
n1 = 2
n2 = 4
There, the wavenumber is given as,
ν = 1/λ
ν = 109677( 1/4-1/16)
ν = 20564.44 cm-1
问题4:当氢原子中的电子从第三激发态跃迁到基态时,德布罗意波长如何与电子变化相关联?
解决方案:
Given: For 3rd excited state n2 = 4,
For Ground state, n1 = 1 and Z = 1.
We know that 1/λ = Z2R(1/n12-1/n22)
1/λ = R(1/12-1/42)
1/λ = 109677 × (15/16)
λ = 16/(109677 × 15)
λ = 97 nm, which lies in the UV region
问题 5:计算在氢光谱的 Paschen 系列中发出的最短波长的光。它属于电磁频谱的哪一部分? (给定:里德堡常数,R = 10 7 m -1 )
解决方案:
In the Balmer series, an electron jumps from higher orbits to the third stationary orbit (n1 = 3).
We know that 1/λ = Z2R(1/n12-1/n22), Z=1
1/λ = R(1/32-1/n22)
For the shortest wavelength, n2 should be ∞.
1/λ = R(1/32-1/∞2)
1/λ = 107(1/9)
λ = 9 x 10-7 m
问题 6:计算氢光谱括号系列中发射的光子的最短波长。它属于频谱的哪一部分? [给定里德堡常数,R = 1.1 × 10 7 m -1 ]
解决方案:
In bracket series, n1 = 4,
for shortest wavelength , n2 = ∞
We know that 1/λ = Z2R(1/n12-1/n22), Z=1
1/λ = R(1/42-1/∞2)
1/λ = R/16
λ = 16/1.1 × 107
After solving we get λ = 1454 nm, which lies in the Infrared region of the spectrum.
问题 7:氢光谱的莱曼系列的短波长极限是 913.4 A。计算氢光谱的巴尔默系列的短波长极限。
解决方案:
λl for layman series = 913.4 Å
We know that 1/λ = Z2R(1/n12-1/n22), Z=1
For the short wavelength of the Lyman series,
1/913.4 = R[1/12−1/∞2]
or
R=(1/913.4)
For a short limit of wavelength for the Balmer series,
1/λb = R[1/22−1/∞2]λb
=4/R
=4(913.4)
or
λb = 365.36 nm.