实体中的缺陷或缺陷
物质可以大致以三种状态存在,即固体、液体和气体。固体是那些在它们之间具有短的分子间作用力的物质,它们使分子(原子或离子)保持紧密排列。它们具有确定的质量、体积和形状。它们的分子间作用力很强,分子间距离很短。它们是刚性且不可压缩的。
固体可以根据其各自组成颗粒的排列中存在的有序性质分为结晶或无定形。结晶固体是大量的小晶体。这些晶体具有明确的特征几何形状。这些晶体内部的粒子排列是有序的,并在所有三个维度上重复。
固体中的缺陷或缺陷
虽然结晶固体按短程和长程顺序排列,但晶体并不完美。固体通常由大量小晶体组成。这些小晶体中存在缺陷或缺陷。
当结晶过程以非常快或中等的速率发生时,晶体中就会出现缺陷。当结晶过程以极慢的速度发生时,就会形成单晶。我们认为缺陷是组成颗粒排列的不规则性。缺陷被认为有两种类型:点缺陷和线缺陷。
Point defects are the deviations or irregularities from the model arrangement around a point or an atom in a crystalline substance, whereas line defects are the irregularities or deviations from the model structuring arrangement in complete rows of different lattice points.
这些不规则性称为晶体缺陷。点缺陷分为三种类型:
- 化学计量缺陷
- 杂质缺陷
- 非化学计量缺陷
化学计量缺陷
化学计量缺陷基本上是不干扰给定固体化学计量的点缺陷。化学计量是在化学反应之前、期间和之后给定数量的反应物和相应产物之间的关系。化学计量缺陷也称为固有或热力学缺陷。
- 空缺缺陷
在晶体中,当一些晶格位置空置时,晶体被称为具有空位缺陷。这导致给定物质的密度降低。当物质被加热时,也会形成这种缺陷。

空缺缺陷
- 间隙缺陷
在晶体中,当一些组成粒子占据间隙位置时,该晶体被称为具有间隙缺陷。与空位缺陷相反,这会导致给定物质的密度增加。

间隙缺陷
注意:在非离子固体中观察到空位和间隙缺陷。Ionic固体需要保持电中性。因此,它们不具有简单的空位和间隙缺陷,而是具有弗伦克尔和肖特基缺陷。
- 弗伦克尔缺陷
这种缺陷存在于离子固体中。较小的离子(主要是阳离子)从其正常位点脱位并移动到间隙位点。这种离子转移会在原始位置产生空位缺陷,并在新位置产生间隙缺陷。因此,弗伦克尔缺陷也称为位错缺陷。它不会影响固体的密度,因为离子仍然存在于结构中。这种缺陷主要存在于离子大小差异很大的离子物质中。例如,ZnS、AgCl、AgBr 和 AgI 显示出 Frenkel 缺陷,因为 Zn 2+和 Ag +离子尺寸较小。
弗伦克尔缺陷的特征
- 这种缺陷只发生在阳离子小于阴离子时。化学属性也没有变化。
- Frenkel 缺陷对固体的密度也没有影响,因此固体的体积和质量都是守恒的。
- 在这种情况下,物质保持电中性。
- 随着相同电荷的离子靠得更近,介电常数上升。
- 由于存在未被占据的晶格位置,具有弗伦克尔缺陷的材料在固态下表现出导电性和扩散性。
- Frenkel 缺陷降低了结晶固体的晶格能和稳定性。该缺陷对离子化合物的化学特性有影响。
- 固体的熵增加。

弗伦克尔缺陷
- 肖特基缺陷
肖特基缺陷就像离子固体中的空位缺陷。在此缺陷中,任务阳离子和阴离子的数量始终保持不变,以保持电中性。就像一个简单的空位缺陷一样,肖特基缺陷最终也会降低给定物质的密度。离子固体中的缺陷数量非常多。这种缺陷可以在具有相似尺寸的阳离子和阴离子的离子固体中观察到。例如,KCL、NaCl、CsCl 和 AgBr。
肖特基缺陷的特征
- 阳离子和阴离子之间的尺寸差异可以忽略不计。
- 阳离子和阴离子都离开固体晶体。
- 原子也永久地从晶体中弹出。
- 在大多数情况下,会创建两个职位。
- 固体的密度显着降低。

肖特基缺陷
例外:AgBr 同时显示 Frenkel 和 Schottky 缺陷。
杂质缺陷
在杂质缺陷中,外来成分或杂质取代了现有离子的位置。例如,如果熔融的NaCl在存在SrCl 2的情况下结晶,则Na +离子的一些位点可能被Sr 2+离子占据。为了保持电中性,每个 Sr 2+离子将替换两个 Na +离子。 Sr 2+离子占据一个Na +离子的位置,而另一个Na +离子位置保持空缺。因此,产生的空位数也等于存在的Sr 2+离子数。
杂质缺陷的其他例子是 CdCl 2和 AgCl。

杂质缺陷
非化学计量缺陷
已知大量的非化学计量无机固体由于其晶体结构中的缺陷而以非化学计量比包含组成元素。这些缺陷有两种类型:
- 金属过剩缺陷
- 金属缺损
- 金属过量缺陷
由于阴离子空位导致的金属过量缺陷——这种缺陷在碱金属卤化物如 NaCl 和 KCl 中观察到。在这种缺陷中,晶体具有过量的阳离子,因为存在的阴离子与外部离子结合形成另一种化合物。例如,当 NaCl 晶体在存在钠蒸气的情况下加热时,Cl –离子扩散并与钠蒸气形成 NaCl。因此,晶体现在存在额外的 Na +离子。这个阴离子位点被一个不成对的电子占据。我们称这个站点为 F 中心。这个词来源于德语单词 Farbenzenter,意思是颜色中心)。这使 NaCl 晶体呈黄色。当这些电子从落在晶体上的可见光中吸收能量时,这些电子的激发就会出现颜色。就像上述情况一样,过量的锂会使 LiCl 晶体呈粉红色,过量的钾会使 KCl 晶体呈紫色(或丁香色)。
金属过量缺陷的后果
具有金属过量缺陷的晶体中存在自由电子导致它们被着色。由于存在自由电子,具有金属过量缺陷的晶体可以导电并且是半导体。因为电传输主要是由“多余的”电子完成的,所以这些被称为 n 型(n 表示负)半导体。由于在晶格位置存在不成对电子,具有金属过量缺陷的晶体通常是顺磁性的。当晶体暴露在白光下时,被俘获的电子会吸收其中的一部分,以便从基态被激发到激发态。色彩由此产生。这些被称为 F 中心。正离子空位伴随着这些剩余离子。这些空位与捕获电子的阴离子空位具有相同的目的。 V-centers 是这个过程产生的颜色中心。
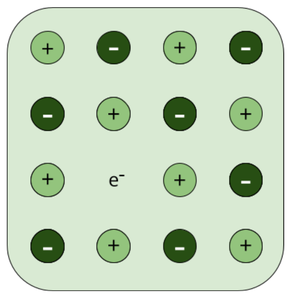
晶体中的 F 中心
金属过量缺陷是由间隙位点存在额外的阳离子引起的——在室温下,氧化锌是白色的。当它被加热时,它会失去氧气并从白色变成黄色。
ZnO ⇢ Zn 2+ + ½O 2 + 2e – (加热时)
正如您在上面的方程式中看到的,现在晶体中存在过量的锌,其分子式变为 Zn 1+x O。多余的 Zn 2+离子转移到间隙位点,相应的电子转移到相邻的间隙位点。
- 金属缺乏缺陷
众所周知,很难以化学计量组成制备几种固体。与化学计量比例相比,这些固体具有较少量的金属。
这种类型的一个完美例子是 FeO,它的成分主要是 Fe 0.95 O。它的范围可能从 Fe 0.93 O 到 Fe 0.96 O。在 FeO 的晶体中,由于缺少 Fe 而失去正电荷2+阳离子。电荷损失被 Fe 3+离子的存在所覆盖,以使物质电稳定。
示例问题
问题1:哪些缺陷会降低物质的密度?解释这些缺陷。
回答:
Density of substance decreases in Vacancy defect and Schottky Defect.
In the crystals, when some lattice sites are left vacant, the crystal is said to have a vacancy defect. This causes a decrease in the density of the given substance. This defect can also form when the substance is heated.
Schottky defect is basically a vacancy defect in given ionic solids. The number of mission cations and anions are always constant in this defect to uphold electric neutrality. Just like a simple vacancy defect, the Schottky defect also ends up decreasing the density of the given substance. The number of defects in ionic solids is pretty significant. This defect can be observed in ionic solids having cations and anions of similar sizes. For example, KCL, NaCl, CsCl and AgBr.
问题2:什么是位错缺陷?举个例子。
回答:
Frenkel defect is present in ionic solids. The smaller ion (mostly the cation) gets dislocated from its normal site and gets moved to an interstitial site. This shift in ion creates a vacancy defect at the original site and an interstitial defect at the new location. Due to this, the Frenkel defect is also called the dislocation defect. It doesn’t affect the density of the solid as the ion is still present in the structure. This defect is found mostly in ionic substances where there is a large difference between the size of the ions. For example, ZnS, AgCl, AgBr, and AgI show Frenkel defects as Zn2+ and Ag+ ions are small in size.
问题 3:哪种化合物同时具有弗伦克尔和肖特基缺陷?
回答:
Silver Bromide (AgBr) is the compound that shows both Frenkel and Schottky defects.
问题 4:解释非离子和离子固体中的缺陷有何不同。
回答:
Vacancy Defect – In the crystals, when some lattice sites are left vacant, the crystal is said to have a vacancy defect. This causes a decrease in the density of the given substance. This defect can also form when the substance is heated.
Interstitial Defect – In the crystals, when some constituent particles occupy an interstitial site, the crystal is said to have an interstitial defect. Contrary to vacancy defect, this causes an increase in the density of the given substance.
Vacancy and Interstitial Defects are observed in non-ionic solids. Ionic solids need to maintain electric neutrality. Thus, they do not have simple Vacancy and Interstitial defects but have Frenkel and Schottky Defects.
问题 5:为什么 NaCl 遇钠过量会变黄?
回答:
When NaCl crystals are heated in presence of sodium vapours, the Cl– ions diffuse and form NaCl with the sodium vapour. Thus, the crystals now have an extra Na+ ion present. This anionic site is occupied by an unpaired electron. We call this site an F-center. This word is derived from the German word Farbenzenter for colour centre). This gives off a yellow colour to the NaCl crystals. The colour appears from the excitation of these electrons when they absorb energy from the visible light falling on the crystals. Just like the above cases, excess Lithium makes LiCl crystals pink and excess Potassium makes KCl crystals violet (or lilac).
问题6:什么是线路缺陷?
回答:
Line defects are the irregularities or deviations from the model structuring arrangement in complete rows of different lattice points.
问题7:什么是热力学缺陷?提及它的类型。
回答:
Stoichiometric Defects are basically the point defects that don’t disturb the stoichiometry of the given solid. Stoichiometry is the relationship between the given quantities of reactants and respective products before, during and following the chemical reactions. Stoichiometric Defects are also called intrinsic or thermodynamic defects.