📅 最后修改于: 2021-01-18 05:02:43 🧑 作者: Mango
物质是由原子组成的分子组成的。根据玻尔的理论,“原子由带正电的原子核和围绕各个原子核绕轨道旋转的许多带负电的电子组成”。当电子从较低的状态上升到较高的状态时,据说它被激发了。激发时,如果电子从原子核中完全去除,则原子被电离。因此,将原子从正常状态提升到该电离状态的过程称为电离。
下图显示了原子的结构。
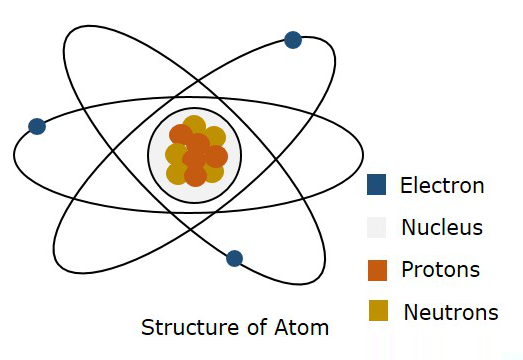
根据玻尔模型,电子被称为在特定的轨道中移动,而根据量子力学,电子被称为在原子的自由空间中的某个位置,称为轨道。这种量子力学理论被证明是正确的。因此,可能在其中发现电子的三维边界称为原子轨道。
量子数
电子在其中移动的每个轨道的能量和形状都不同。轨道的能级可以使用称为量子数的一组离散积分和半积分来表示。有四个用于定义波函数的量子数。
主量子数
描述电子的第一个量子数是主量子数。它的符号是n 。它指定号码的大小或顺序(能级)。随着n值的增加,从电子到原子核的平均距离也增加,电子的能量也增加。主要能级可以理解为壳。
角动量量子数
该量子数以l为符号。 l表示轨道的形状。取值范围是0到n-1。
l = 0,1,2…n-1
对于第一个壳,n = 1。
即,对于n-1,当n = 1时,l = 0是l的唯一可能值。
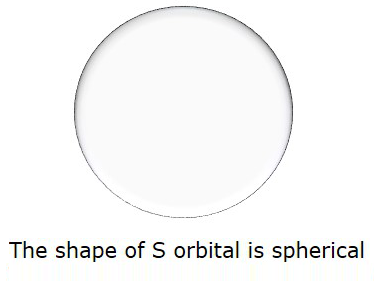
因此,当l = 0时,称为S轨道。 S的形状是球形。下图表示S的形状。
如果n = 2,则l = 0,1,因为这是n = 2的两个可能值。
我们知道,对于l = 0,它是S轨道,但是如果l = 1,则它是P轨道。
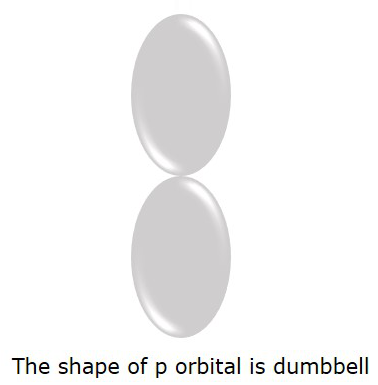
电子更容易找到的P轨道为哑铃形。如下图所示。
磁量子数
该量子数由m 1表示, m 1表示围绕核的轨道的取向。 m l的值取决于l。
$$ m_ {l} = \ int(-l \:\:to \:+ l)$$
对于l = 0,m l = 0,这表示S轨道。
对于l = 1,m l = -1、0,+ 1,这是三个可能的值,并且表示P轨道。
因此,我们有三个P轨道,如下图所示。
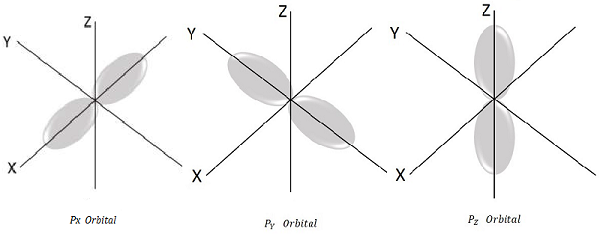
自旋量子数
这由m s表示,这里的电子在轴上旋转。电子旋转的运动可以是顺时针方向或逆时针方向,如下所示。
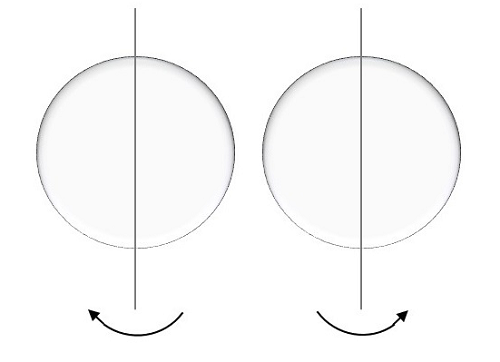
该自旋量子数的可能值如下:
$$ m_ {s} = + \ frac {1} {2} \:\:up $$
对于称为旋转的运动,结果为正一半。
$$ m_ {s} =-\ frac {1} {2} \:\:down $$
对于称为降落运动的运动,结果为负一半。
这是四个量子数。
保利排除原则
根据保利排除原理,一个原子中没有两个电子可以具有四个相同的量子数的相同集合。这意味着,如果任何两个电子的n,s,ml值相同(如上所述),则l值肯定会不同。因此,没有两个电子具有相同的能量。
电子外壳
如果n = 1是一个外壳,则l = 0是一个子外壳。
同样,n = 2是一个壳,l = 0,1是一个子壳。
对应于n = 1、2、3…..的电子的壳分别由K,L,M,N表示。子壳或对应于l = 0、1、2、3等的轨道分别用s,p,d,f等表示。
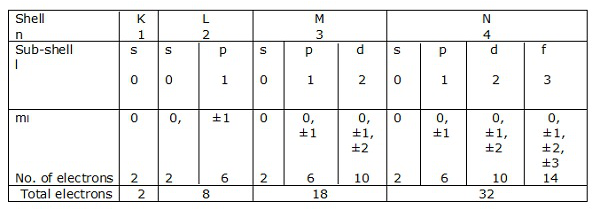
让我们看一下碳,硅和锗的电子配置(IV – A组)。

可以看出,在每种情况下,最外面的p子壳仅包含两个电子。但是电子的可能数目是六个。因此,每个最外层壳中都有四个价电子。因此,原子中的每个电子都有特定的能量。任何类型的物质中分子内部的原子排列几乎都是这样。但是原子之间的间距因材料而异。